(Bu yazı GENÇ İVEK SAĞLIK BİLİM VE TEKNOLOJİLERİ DERGİSİ’nin 8. sayısında yayımlanmıştır.)
CEM ÇALIŞKAN
Analitik Geliştirme Müdürü
PhD (c)
Günümüzde teknolojinin ilerlemesiyle birlikte insan sağlığına verilen önem giderek artmıştır. Kullanmış olduğumuz gıda, ilaç, kozmetik vb. ürünler içerisinde var olan ve insan sağlığını tehdit eden etkenlerin tespit edilmesi sırasında, yapılan miktar tayini, içerik tekdüzeliği, nem, çözünme, etkin madde ya da yardımcı madde kaynaklı safsızlıkların kontrolü gibi parametrelerin analizleri yetersiz görülmektedir. Uluslararası İnsan Kullanımı İçin İlaçlar İçin Teknik Gereksinimlerin Uyumlaştırılması Konseyi (ICH), Dünya Sağlık Örgütü (WHO), Amerika Gıda ve İlaç İdaresi (FDA), Avrupa İlaç Ajans (EMA) ve T.C. Sağlık Bakanlığı gibi ulusal ve uluslararası otoriteler safsızlık çalışması konularında hassasiyetlerini arttırmışlardır. Bu kapsamda her geçen gün yeni gereklilikler ortaya çıkmaktadır. İlaçlar ve tıbbi cihazların hastaya zarar verecek herhangi bir safsızlık içermemesi, ilacın üretiminden ambalaj malzemesine hatta depolanmasına kadar güvenliğinin garanti edilmesi gerekmektedir. Bir ilaç ürünü için, formülasyon içeriği olmayan herhangi bir bileşen, safsızlık olarak kabul edilir. Bu safsızlıkları tespit etmeden ve ortadan kaldırmadan, ilaç ürünlerinin kalitesi, güvenliği ve etkinliği risk altına girer.
İleri teknoloji cihazların oluşturduğu farkındalıklar nelerdir? 1980’lerde, ABD Gıda ve İlaç Dairesi’nin (FDA), ekstrakte edilebilir ve sızabilir safsızlıklardan kaynaklanan hasta duyarlılığı bulguları ve potansiyel güvenlik endişelerinden sonra ortaya çıkan, özellikle paketleme sistemi ile dozaj formu etkileşimi için uygulama yoluna göre yüksek risk olarak kabul edilen birçok dozaj formu olduğunu belirtmiştir. Farmasötik safsızlıklar; aktif farmasötik bileşenler (API’ler) veya ilaç ürünü formülasyonları ile bir arada bulunan istenmeyen kimyasallardır. İlaç maddelerinde bulunan safsızlıklar ve miktarları, nihai farmasötik ürünün güvenliğini belirlediğinden, safsızlıkların tanımlanması, miktar tayini, kalifikasyonu ve kontrolü, ilaç geliştirme sürecinin kritik bir parçasıdır. ICH, FDA ve EMA gibi çeşitli düzenleyici otoriteler, safsızlıkların kontrolüne odaklanır ve bu konularda kılavuzlar yayınlamaktadırlar.
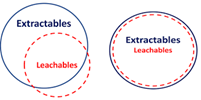
Ekstrakte edilebilirler, bir farmasötik ambalaj ürününden ekstraksiyon yoluyla çözücüye salınabilen tüm organik ve inorganik kimyasal yapıları ifade eder. Ekstrakte edilebilir maddeler, normal saklama ve kullanım koşulları altında bir ilaç ürününe sızma potansiyeline sahiptir ve böylece sızabilir hale gelir. Sızabilir maddeler, normal depolama kullanım koşulları altında veya hızlandırılmış stabilite çalışmaları sırasında ambalaj malzemesinden paketlenmiş ilaç ürününe sızabilecek yabancı kimyasallar anlamına gelir. Kaliteli ürün üretmenin ötesinde ürün kalitesinin sürdürülebilirliği için ilaç firmaları, potansiyel olarak zararlı materyallerin ambalajdan hastaya aktarılmamasını sağlamak ile yükümlüdür.
Haziran 2018’de Valsartan içeren bazı ilaç ürünlerinde ve hammaddelerde N-nitrozodimetilamin (NDMA) olarak adlandırılan ve kanserojen olduğu bilinen safsızlığın tespit edilmesiyle birlikte FDA, EMA gibi sağlık otoriteleri bu ürünlerin kontrol edilmesi için geri çağrılarda bulundu ve birtakım yönetmelikler yayınlandı. 2019 yılında, ranitidin gibi mide ekşimesini önlemek, hafifletmek için kullanılan bazı reçetesiz ilaçların ve bazı metformin ürünlerinin de NDMA içerdiği tespit edilince bazı geri çağırmalar söz konusu oldu ve nitrozaminler tamamen odak noktası haline geldi.

Hastalar için iyileştirme özelliği bulunmayan, etkin madde ya da yardımcı maddelerin üretim prosesinde katalizör olarak kullanılan kimyasallardan, üretim ekipmanlarından ya da kap-kapak sistemlerinden sızabilen elementel safsızlıklar içinde otoriteler tarafından kısıtlamalar konulmuştur. Özellikle ICH Q3D (R1) kılavuzunda bazı elementler toksisitelerine ve ilaç ürününde meydana gelme olasılıklarına göre 3 farklı sınıfa ayrılmıştır ve günlük maruziyet limitleri belirtilmiştir.
Tüm bu nedenlerle ulusal ve uluslararası regülasyonlar bazı ileri düzey analitik çalışmalar gerektirmektedir. Bunlar;
- İlaçlarda bilinmeyen safsızlıkların tanımlanması,
- Genotoksik, karsinojenik, teratojenik safsızlıkların kontrolleri,
- Primer ambalaj malzemelerinden ya da stabilite süresince depolama koşullarından kaynaklanabilecek Ekstrakte edilebilir ve Sızabilir safsızlıkların kontrolü,
- Nitrozamin safsızlıkları,
- Elementel impürite,
- Bilinmeyen safsızlıkların karakterizasyonu şeklinde sıralanabilir.
Ülkemizde ileri teknolojiyi kullanarak ilaç kalitesine katkıda hangi noktadayız? Milli ilaç kalitemizin artması ve ülkemizde dışa bağımlı olmadan, bu analizleri gerçekleştirmek adına büyük yatırımlar sağlayarak özel laboratuvarlar kuran öncü firmalarımız bulunmaktadır. Bu laboratuvarlarda elementel impürite ve ağır metal tayini, mevcut kütüphane taramaları sayesinde bilinmeyen safsızlıkların tanımlanması, ambalaj malzemelerinin ekstrakte edilebilirler profillerinin belirlenmesi ve ürünlerdeki sızabilirlerin kontrolleri, nitrozamin safsızlıklarının tespit edilmesi gibi ürün kalitesi açısından oldukça önem arz eden birçok analiz yapılmaktadır. Bu ileri düzey analitik çalışmalar; yüksek lisans ve doktora derecesine sahip, cihaz kullanımı açısından kalifiye personellerin olduğu güçlü, donanımlı Ar-Ge ekiplerinin işbirliği sonucunda gerçekleşir.

Ar-Ge ve yenilik yoluyla ülke ekonomisinin uluslararası düzeyde rekabet edebilir bir yapıya kavuşturulması için teknolojik bilgi üreterek, üründe ve üretim süreçlerinde yenilik yapılmasını, ürün kalitesi ve standardının yükseltilmesini, teknolojik bilginin ticarileşmesini, rekabet öncesi işbirliklerinin gelişmesini ülkemizde yapılan bu çalışmalarla gerçekleştirebiliriz.
Sağlığın bizim için paylaşılan bir hazine olduğunu düşünürsek, korunması için her gün gelişen teknolojiyi kullanarak daha fazla çalışmamız ve üretmemiz gerektiğinin bilincinde olarak var gücümüzle çalışıyoruz.
Türkiye dışa bağımlı olmayan ilaç analizleri için neler yapıyor?
Ar-Ge ve yenilik yoluyla ülke ekonomisinin uluslararası düzeyde rekabet edebilir bir yapıya kavuşturulması için öncelikle teknolojik bilgi üreterek, üründe ve üretim süreçlerinde yenilik yapılmalı, ürün kalitesi ve standardı yükseltilmelidir. Ayrıca, üretilen teknolojik bilginin ticarileştirilmesi ve rekabet öncesi işbirliklerinin gelişmesi de ülkemizi dışa bağımlı olmaktan kurtaracaktır. Sonuç olarak, hem ulusal hem de uluslararası açıdan ilaç endüstrisinin bugünü ve yarınını düşündüğümüz zaman iyi yatırımlar, güçlü AR-GE ekipleri, dijital teknolojiler ve işbirliklerinin kurulmasıyla ülkemizde insan sağlığının korunmasında yapılan ileri cihaz ve analiz çalışmalarına ivme kazandırmış oluruz.
Kaynaklar
- USP <1663> Assessment of Extractables Associated with Pharmaceutical Packaging/Delivery Systems, Currently Official as of 1-Dec-2020.
- USP <1664> Assessment of drug product leachables associated with pharmaceutical packaging/delivery systems, Currently Official as of 1-Dec-2020.
- Guidance for Industry, Container Closure Systems for Packaging Human Drugs and Biologics, FDA, May, 1999.
- Control of Nitrosamine Impurities in Human Drugs, FDA, September 2020.
- ICH Q3D (R1) Guideline for Elementel Impurities, Final version, Adopted on 22 March 2019.
