(Bu yazı GENÇ İVEK SAĞLIK BİLİM VE TEKNOLOJİLERİ DERGİSİ’nin 8. sayısında yayımlanmıştır.)
LOKMAN TUNCA
Biruni Üniversitesi
Tıp Bölümü Lisans Öğrencisi
Önceki sayılarımızda CRISPR teknolojisinden genel olarak bahsedip farklı türlerine değindikten sonra bu sayımızda da CRISPR teknolojisinin hangi hastalıklarda kullanılabileceği veya kullanılmak üzere olduğuna değineceğiz. Öncelikle neredeyse tüm genetik geçişli hastalıklarda ve genetik alt yapısı olmayan bazı hastalıklarda CRISPR teknolojisi ile tedavi denenmiş olup araştırmak istediğiniz hastalıkla birlikte CRISPR yazarak aratırsanız birçok makaleye ulaşabilirsiniz. Burada bahsi geçecek hastalıklardan ikisi büyük yatırımlarla kliniğe geçmeye yakın tedavi seçenekleriyken son hastalıksa ilgi çekici tedavi şekli ve diğer hastalıklara tedavide bakış açısı kazandırabilmesi amacıyla bu yazıda bulunmaktadır. Bu nedenle bu hastalıklarda daha çok bilgi sahibi olunan CRISPR-Cas9 teknolojisi kullanılmaktadır. Ayrıca yazının sonunda paylaşılan internet adreslerine göz atmanızı öneririz. Tıpta kişiselleştirilmiş tedaviler yaygınlaşmaya başlamışken çok da ileride olmayan bir dönemde genetik tedaviler hızlıca hayatımıza girecek gibi duruyor. Bu konularda da kendimizi yetiştirmeyi ihmal etmemeliyiz.
Bu yazıda Orak Hücreli Anemi (SCD), Duschenne Muskuler Distrofi (DMD) ve kolesterol yüksekliği hastalıklarından ve CRISPR teknolojisi ile tedavilerinden kısaca bahsedilecektir. Özellikle onkoloji alanında da sıkça kullanılan bu tedavi şeklinin daha ayrıntılı araştırmasını yapmanıza sizi teşvik edebilmek bu yazının temel amacıdır.
Orak Hücreli Anemi (Sickle Cell Disease-SCD)
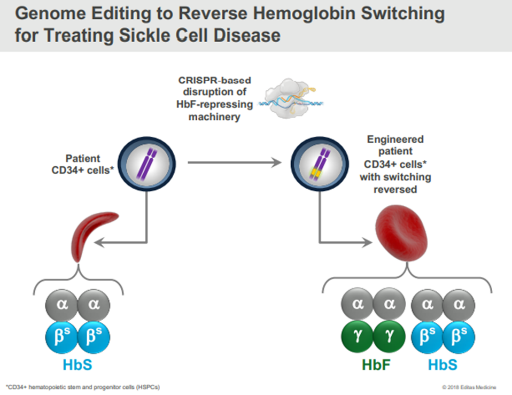
Damarlarımızın içinde dolaşan kanın temel hücresi eritrositlerdir. Eritrositlerin içerisinde Oksijen taşınmasına olanak sağlayan Hemoglobinler (Hb) bulunmaktadır. Hemoglobinlerlerin yapısında ise 4 globin proteini bulunur. Her bir globin zincirinde demir elementi bulunur ve buna bağlanan oksijen dokulara eritrositler vasıtasıyla taşınır. (Şekil 1.1)
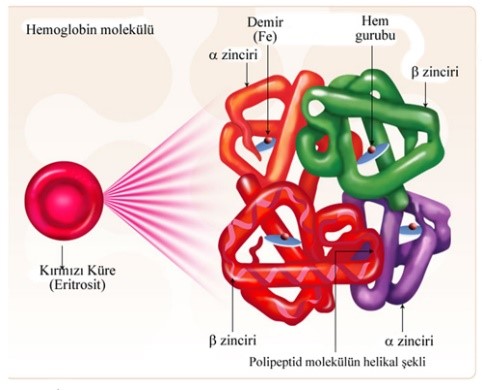
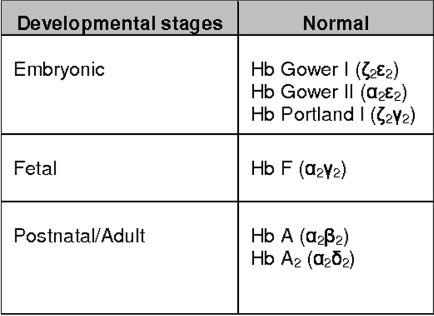
Hemoglobinlerin yapısında bulunda globin zincirleri yaşamın farklı evrelerinde, farklı kromozomlardan sentezlenen farklı tipte proteinlerdir. (Şekil 1.2) Örnek olarak anne karnında ve doğumdan sonra ilk 6 ayda HbF (fetal) hakimken 6 aydan sonra HbA hakimiyeti başlar. HbA’da olup HbF’de olmayan globin zinciri beta (β) globülindir.
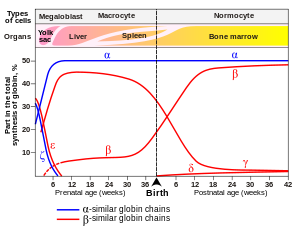
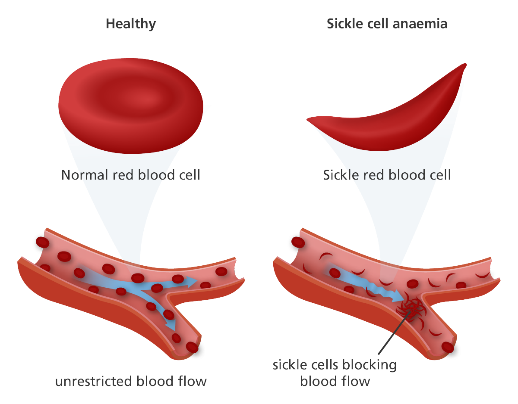
CRISPR-Cas9 teknolojisi ile hastadan toplanan CD34(+) hematopoetik kök hücreler (farklı kan hücrelerine farklılaşabilen kök hücre) genetik olarak değiştirilir. Doğumdan sonraki 6. Ayda HbF sentezini engellemek üzere görevli bir mekanizma bulunmaktadır. Böylece HbA yetişkin dönemde yükselebilir. CRISPR tedavisinde bu HbF inaktivasyon mekanizması hedeflenerek inaktive edilir. Böylece HbF tekrar artmaya başlar. (Şekil 1.4) Yapılan çalışmalarda semptomları azaltacak ve geçirecek düzeyde etki ettiği gösterilmiştir. Daha ayrıntılı sonuçlarına yazının sonundaki kaynakçadan ulaşabilirsiniz.
Duschenne Kas Distrofisi (Duschenne Muskuler Distrofi-DMD)
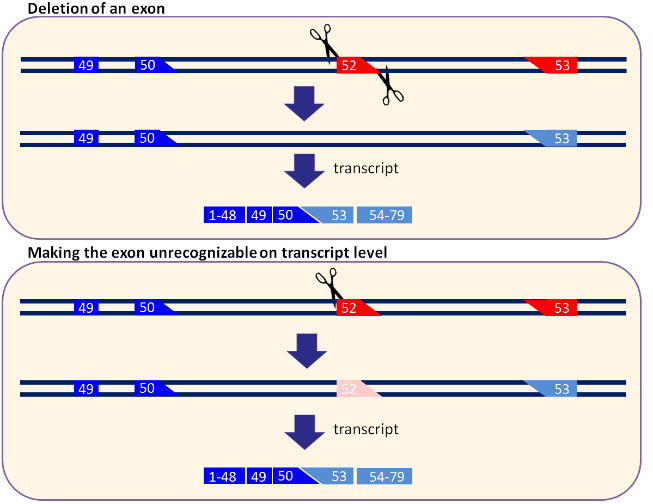
DMD X’e bağlı kalıtım gösteren erkeklerde izlenen çocukluk çağının en ağır seyirli ve en sık izlenen nöromuskuler hastalığıdır. 3600 erkek doğumunda bir izlenir. Çocuklar yürümeyi öğrenene kadar her şey normal görünür. En erken bulgusu proximal kas güçsüzlüğü bulguları denilen merdiven çıkamama, saçını tarayamama, ayağa kalkarken zorlanmadır. Bu hastalıkta kas hücre iskeleti elemanlarını ekstraselüler alana bağlayıp kasın dayanıklılığından sorumlu olan distrofin geni sorunludur. 10-12 yaşlarında yatağa bağımlı hale gelen bu çocuklar solunum yetmezliği ve kalp yetmezliği gelişmesiyle erken yaşta vefat ederler. Distrofin geninde frame shift denilen mutasyon sıktır. Genin belli bir kısmında olan mutasyon tüm genin translasyonunu bozar ve oldukça yanlış bir protein sentezlenir. Tedavide distrofin geninde mutasyonun bulunduğu asıl kısmın (exon 52) komple çıkarılması veya translasyona dahil olamayacak hale getirilmesi amaçlanmaktadır. CRISPR ile exon kısmının iki ucu kesilerek veya exon kısmındaki belli bir bölgede CRISPR ile zincir kırığı oluşturarak exon skipping yapılır ve distrofin geninin transkripsiyonundaki frame shift düzeltilir. (Şekil 2.1)
Kolesterol (LDL) Yüksekliği ve PCSK9 Geni
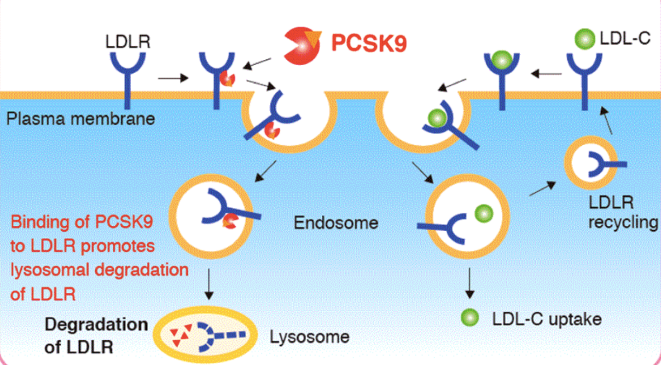
Kalp damar hastalıklarının yarısının nedeni kolesterol yüksekliğidir. LDL insan vücudunda karaciğer hücresinin yüzeyinde bulunan LDL reseptörlerine bağlanarak karaciğer hücresinin içerisine alınır. Karaciğer hücresine alınan LDL karaciğerdeki metabolik reaksiyonlarda kullanılırken LDL reseptörü kanda dolaşan yeni LDL’leri karaciğere alabilmek için tekrar hücre yüzeyine yerleştirilir. (Şekil 3.1) Böylece kanda LDL düzeyleri nomal seviyelerde tutulur. PCSK9 geni tarafından sentezlenen PCSK9 proteini LDL reseptörüne bağlanırsa LDL’yi yakalayan LDL reseptörü hücre içine girdiğinde tekrar hücre yüzeyine çıkmak yerine hücre içerisinde yıkılır. LDL reseptörlerinin PCSK9 nedeniyle hücrede yıkılması hücre yüzeyinde bulunan LDL reseptörlerinin sayısının azalmasına, LDL seviyelerinin kanda yükselmesine ve kalp damara hastalıklarına neden olur. (Şekil 3.1) Avrupa popülasyonunun %1’inde PCSK9 geni mutant haldedir. Bu nedenle bu kişilerde kolesterol düzeyleri ve kalp hastalıkları riski daha düşüktür. Ayrıca şu an PCSK9 proteinini hedefleyen ve LDL reseptörüne bağlanmasını engelleyen PCSK9 antikorları Faz 3 aşamasında olup birçok hasta tarafından kullanılmıştır.
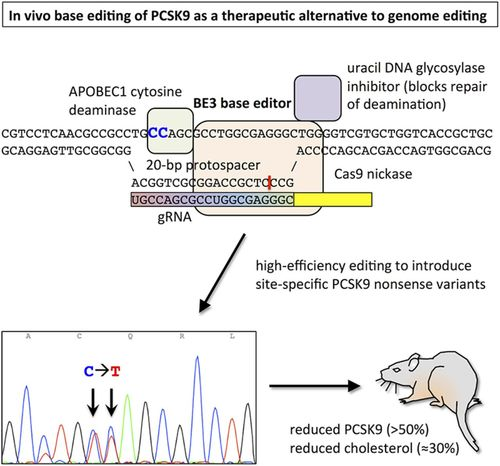
CRISPR ile sadece karaciğer hücreleri hedeflenerek (karaciğer spesifik adenovirusler ile) PCSK9 geninde orak hücreli anemide olduğu gibi dışarıda genetik değişiklik yapıp vücuda vermenin aksine in vivo olarak canlı vücudunda- mutasyon oluşturulmaya çalışıldı. Farelerde yapılan bu deneyde sonuç olarak verilen virusun tüm karaciğer hücrelerine girmemesine rağmen PCSK9 düzeyinde %50’den fazla düşüş sonucu kolesterol seviyesinde %30’a yakın düşüş izlendi. (Şekil 3.2) Bu deneyden sonra insan hücrelerinde ve virus kullanılmadan yapılan başarılı PCSK9 mutasyon çalışmları da oldu.
Kaynaklar
- https://www.editasmedicine.com/
- Chang et al ASH 2018
- Mol Diagn Ther. 2019 Apr;23(2):201-222. doi: 10.1007/s40291-019-00392-3.
- http://www.crisprtx.com/programs/hemoglobinopathies
- https://www.nature.com/articles/cr201716
- https://www.editasmedicine.com/wp-content/uploads/2020/12/EDIT-301-ASH-Poster.pdf
