(Bu yazı GENÇ İVEK SAĞLIK BİLİM VE TEKNOLOJİLERİ DERGİSİ’nin 6. sayısında yayımlanmıştır.)
Ahmet Nafiz Yinanç
İstanbul Yeni Yüzyıl Üniversitesi-Eczacılık Lisans Öğrencisi
COVID-19’un tanı ve tedavisinde, mikrobiyoloji laboratuvarı kritik öneme sahiptir. Akut COVID-19 enfeksiyonunu belirlemek için güncel olan tanı testi gerçek zamanlı, reverse-transkripsiyon polimeraz zincir reaksiyonu (real-time reverse-transcription polymerase chain reaction, rRT-PCR) testidir. COVID-19 pandemisi yayılmaya devam ettikçe ve vakalar biriktikçe, serolojik testler pandeminin geçmişini anlamak ve geleceğini tahmin etmek için giderek önemli hale gelmektedir. Serolojik analizler, halk sağlığı pratiğinde vakaları bulma, yakın temaslıları izleme ve karantina tavsiyesi için faydalıdır. Doğru zamanda yapıldıklarında moleküler testleri destekleyici olabilirler.
Tanı Alınması
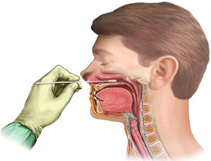
Uygun solunum yolu örneğinin doğru zamanda, doğru şekilde ve doğru anatomik bölgeden alınması, COVID -19 enfeksiyonunun moleküler tanısında esas rolü oynar. Daha yüksek tanısal verim alınabilmesi, hasta tarafından daha iyi tolere edilebilmesi ve örneği alan için güvenli olması bakımından, üst solunum yolunu temsilen nazofarenjeal (NF) ve orofarenjeal (OF) örnekler birlikte alınmalıdır. Aynı eküvyonla önce orofarengeal sonra nazofarengeal sürüntü alınır, eküvyon tek bir sıvı viral transport ortamı (VTM) içine yerleştirilir.
Moleküler Tanı Yöntemleri
1-) Sekans analizleri:
Yeni nesil sekanslama yöntemleri kullanılarak çok sayıda SARS-CoV-2 virüsünün tüm genom baz dizisi çıkarılmaktadır. Bu çalışmalarla genomundaki mutasyonları araştırmak, virüsün moleküler epidemiyolojik çalışmalarını yapmak ve şüpheli RT-PCR sonuçlarını doğrulamak mümkündür. Ancak bu testler, COVID-19 enfeksiyonlarının tanısı için pratik değildir. SARS-CoV-2 enfeksiyonunun etiyolojik tanısında RT-PCR testi, tavsiye edilen ve tercih edilen moleküler testtir. Gerektiğinde nükleik asit baz dizi analizi ile doğrulanması tavsiye edilir.
2-) RT-PCR
DNA replikasyonu yani DNA’nın kendini eşlemesi, DNA ipliğinin kalıp olarak kullanılıp çoğaltılmasıdır. Prokaryot hücrelerde replikasyon, halkasal bakteri kromozomunda belirli bir noktadan başlar. Replikasyon orjini adı verilen bu noktadan başlayarak, DNA kendini tümüyle eşleyene kadar, iki yönde ve aynı hızda sentezlenir.
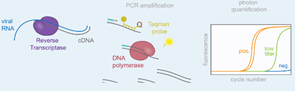
Revers-Transkriptas Polimeraz Zincir Reaksiyonu (rRT-PCR)
Revers-Transkriptaz Polimeraz Zincir Reaksiyonu (rRT-PCR); hücrelerden izole edilen RNA moleküllerinin retrovirüslerden izole edilen Revers transkriptaz enzimi yardımıyla komplementer DNA (cDNA) sentezini gerçekleştirmesi sonucu, gen ekspresyonu analizlerinin yapılabildiği hızlı ve hassas bir yöntemdir. Bu yöntemle ile çok az miktarda RNA ile oluşan mesajlar saptanabilir, ekspresyon miktarı da tesbit edilebilir. Oluşan rRT-PCR ürünleri klonlama da vektör olarak kullanılabilir, bu ürünlerden cDNA kütüphaneleri oluşturulur ki bunlar daha sonra gen kütüphaneleri olarak değerlendirilir. RNA analiz tekniklerinden; RNA hibridizasyonu, RNaz koruma yöntemleri, in situ hibridizasyon ve SI nükleaz yöntemleri ile kıyaslandığında daha hassas, hızlı, güvenilir ve kolay bir yöntemdir.
rRT-PCR’ın COVID-19 Tespitinde Kullanılması
rRT-PCR testlerinin avantajı amplifikasyon ve analizin eş zamanlı olarak yapılması ve amplifikasyon ürününün kontaminasyonuna ilişkin yanlış pozitif sonuçları en aza indirmek için kapalı bir sistem kullanılmasıdır. rRT-PCR test yapılması önerilen durumlar şunlardır.
1. COVID-19 semptomları olan şüpheli vakaları doğrulamak,
2. COVID-19 ile ilişkili semptomları olan yatan hastalarda tanı koymak,
3. Doğrulanmış COVID-19 hastalarının karantinadan çıkarılmasına karar vermek,
4. Şüpheli/kesin COVID-19 hastası ile temas etmiş asemptomatik bireyleri taramak,
5. Solunum yolu semptomları olanların ayırt edici tanısını koymak
Pozitif-polariteli, tek sarmallı RNA genomu içeren SARSCoV-2’nin genomumda rRT-PCR testlerinde kullanılan çok sayıda hedef bölge bulunmaktadır. Bunlar, spike (S) ve zarf (E), transmembran (M) ve nükleokapsid (N) dahil yapısal proteinlerdir. Yapısal proteinleri kodlayan bu genlere ek olarak, türe özgü viral replikasyon için gerekli olan aksesuar genlerde vardır: Bunlar RNA’ya bağlı RNA polimeraz (RdRp) ve ORF1a, ORF1b bölgelerini kapsar. rRT-PCR testinde hedef gen bölgesi olarak CDC, viral nükleokapsid proteinin iki gen bölgesini [N1 ve N2] ve RNA ekstraksiyonu için internal kontrol olarak insan RNAase P genini, DSÖ ise ilk tarama için E ve ardından doğrulama testi için de RdRp gen bölgesinin hedef alınmasını önermektedir. Her ikisinin de analitik duyarlılık ve özgüllüğü yüksektir. Herhangi birinin kullanılmasının, klinik tanı testlerinde bir avantaj sağladığı gösterilmemiştir. Endemik koronavirüslerle çapraz reaksiyonu ve SARS-CoV-2 genetik kaymalarını engellemek için testlerde en az iki moleküler hedef önerilmektedir.
COVID-19 Tespitinde Serolojik Tanı Yöntemleri
Serolojik Testlerin Uygulanması ve Sınırlamalar:
DSÖ, SARSCoV-2 serolojisinde akut ve iyileşme fazında alınacak örnekler için, ilk serum örneğinin hastalığın 1. haftasında, ikincisinin 3-4 hafta sonra alınmasını önermektedir. Sadece tek bir serum alınabilecekse, semptomların başlamasından en az 3 hafta sonra alınması önerilmektedir.
Serolojik testlerin kullanımında bazı sınırlamalar vardır:
• Özellikle enfeksiyonun akut fazında hastalığı saptamada, testlerin duyarlılığı ve özgüllüğü değişkendir. Erken tanı ve taramada rolü yoktur.
• Diğer Koronavirüslerle çapraz reaksiyona bağlı yanlış pozitif sonuçlar verebileceğinden, sonuçların doğrulanması gereklidir.
• SARS-CoV-2 yeni koronavirüs olduğundan bağışıklık için gerekli olan eşik değerleri belirlemek, zamanla antikor kinetiğini anlamak gerekir.
• Testin yaygın kullanımı için güvenilir ve maliyet etkin olması gerekir.
Antijen Saptama Testleri
Doğrudan klinik örneklerden solunum virüslerini saptamak için kullanılan POC testleri SARS-CoV-2 için de geliştirilmiştir. Ancak bu testlerin duyarlılığı ve doğru yorumlanması konusundaki solunum yolu virüsleri ile ilgili sorunlar, SARS-CoV-2 için de devam etmektedir. SARS-CoV-2 nükleokapsit proteinine karşı monoklonal antikorlar üretilmiştir. Bu antikorlar gelecekte hızlı antijen saptama testlerine temel oluşturabilir. Antijen testleri, COVID-19 hastalarındaki virüs yükünün düşük olması durumunda veya örnek tipine bağlı olarak hatalı negatif sonuçlar verebilmektedir.
Antikor Saptama Testleri
Klinik örneklerden SARS-CoV-2 ye karşı antikorları (IgG, IgM ve IgA) tanımlayan serolojik testler, moleküler testlere göre daha az komplekstir. Hastalık belirtileri başladıktan sonra doğru zamanda yapılırsa, aktif ve pasif enfeksiyonu gösterebilen, moleküler testleri destekleyici testler olarak kullanılabilir. Surveyansta tek tanı yöntemi olarak rRT-PCR kullanılması, geçirilmiş enfeksiyonları saptayamamaktadır. SARS-CoV-2’nin yapısal proteinlerinden N ve S önemli antijenik bölgeler olarak görünmektedir ve COVID-19 saptanması için geliştirilen serolojik testlerde kullanılmaktadırlar. N proteini, nükleokapsidin yapısal bileşenidir ve virüsün patogenezinde, çoğalma ve RNA paketlemesinde önemli fonksiyonu vardır. Erken tanıda en önemli antijenlerden biri olabilir. Bu protein COVID-19’un ilk iki haftasında serum ya da idrar örneklerinde pik yapmaktadır. Büyük protein olması sebebiyle ELISA testlerinde kullanıma uygundur. N antijenik bölgesine karşı antikorları saptayan testlerin duyarlılığı, S antijenininkine göre daha yüksektir. İkinci antijenik bölge olan S glikoproteini ise konak hücrelere girişi sağlar, S1 ve S2 alt birimlerinden oluşur. S1, ACE-2 reseptörüne bağlanma bölgesi (RBP-S) olup, S2 ise membran füzyonunu gerçekleştirir. S1 alt biriminin aminoterminal ucu en fazla değişken immunojenik antijendir. S protein, nötralizan antikorlar ve aşı çalışmaları yanında serolojik çalışmalarda da hedef molekül olarak kullanılmaktadır. Her iki antijenin birden kullanıldığı serolojik testlerde çapraz reaksiyonlar önlenir, IgM ve Ig G saptanma duyarlılığı artar.

Sonuç olarak, özellikle toplumsal kaynaklı şüpheli COVID-19 vakalarının ayırt edilmesi açışından, mikrobiyolojik laboratuvar tanısının önemine odaklanılması gerekir. Ancak, COVID-19 enfeksiyonu tanısı için %100 güvenilir bir tanı testi yoktur. Bir vakada kullanım için uygun bir test diğeri için yetersiz olabilir. Şu an için, semptomatik hastaların tanısında RT-PCR testleri gereksinimleri büyük ölçüde karşılamasına rağmen; inkübasyon dönemindeki asemptomatik bireylerin taranması ve tedavi sonrası canlı virüs saçılımının anlaşılması konusundaki katkıları sınırlıdır. SARS-CoV-2’ye karşı konakta oluşan antikorların saptanması, surveyans, salgın tahmini ve bağışıklığı anlamak için çok daha güvenli serolojik testlere gereksinim vardır. Test sonuçlarının hasta yönetiminde kullanılabilmesi için testlerin kullanım amaçları, analitik duyarlılığı, özgüllüğü ve test edilen popülasyonla ilgili özelliklerin dikkate alınması gerekir. Moleküler testler için optimal klinik örnek alma zamanı, tipi ve virüsün konaktaki çoğalma dinamiğinin, serolojik testler için ise çeşitli popülasyonlarda hastalığın şiddetine göre bağışıklık seyrinin bilinmesi gerekmektedir. Daha güvenilir sonuçlar verebilecek serolojik testlerin geliştirilmesi ve mevcut moleküler testlerle karşılaştırılması konularında araştırmalara gereksinim devam etmektedir.
Kaynaklar
Durmaz, Bengül. “COVID-19 Enfeksiyonunda Mikrobiyolojik Tanı.” Yüksek İhtisas Üniversitesi Sağlık Bilimleri Dergisi 2020;1:12−17
Tang YW, Schmitz JE, Persing DH, Stratton CW. The Laboratory Diagnosis of COVID-19 İnfection: Current Issues and Challenges J Clin Microbiol 2020 May 26;58(6): e00512-20. doi: 10.1128/JCM.00512-20
Ozma MA, Maroufi P, Khodadadi E, Köse S, Esposito I, Ganbarov K et al. Clinical manifestation, diagnosis, prevention and control of SARS-CoV-2 (COVID-19) during the outbreak period. Le Infezioni in Medicina, n. 2, 153- 165, 2020.
Wright J,.Color Atlas of Genetics,Nobel Tıp Kitapevi, Türkiye, 2000; 38.
Santagati S, Garnier M, Carlo P, et al. Quantitation of low abundance mRNAs in glial cells using different polymerase chain reaction (PCR)-based methods, Br Res Prot 1997; 217.
Hong K, Lee SW, Kim TS, Huh HJ, Lee J, Kim SY et al. Guidelines for Laboratory Diagnosis of Coronavirus Disease 2019 (COVID-19) in Korea. Ann Lab Med 2020 40: 351-360; doi: 10.3343/alm.2020.40.5.351
Padhi A, Kumar S, Gupta E. Laboratory Diagnosis of Novel Coronavirus Disease 2019 (COVID-19) İnfection. Saxena SK. (ed) Coronavirus Disease 2019 (COVID-19) Epidemiology, Pathogenesis, Diagnosis and Therapeutics. (eBook) doi.org/10.1007/978-981-15-4814-7
Ismail AA. Serological tests for COVID-19 antibodies: Limitations must be recognized. Annals of Clinical Biochemistry.May14, 2020. doi:10.1177%2F0004563220927053
Lu H, Stratton CW, Tang YW. An Evolving Approach to the Laboratory Assessment of COVID-19, 2020 Apr 29. doi: 10.1002/jmv.25954
Sethuraman N, Jeremiah SS, Ryo A. Interpreting Diagnostic Tests for SARSCoV-2. JAMA 6 May 2020; doi: 10.1001/jama.2020.8259)
https://www.interchim.com/upload/Flock d_Swabs_Covid19_coronavirus_Interchim01_0420.png
Esbin, N. Meagan. Whitney, N. Oscar. Chong, Shasha.”Overcoming the bottleneck to widespread testing: A rapid review of
nucleic acid testing approaches for COVID-19 detection” RNA published online May 1, 2020
Pan, Yunbao. Li, Xinran. “Serological immunochromatographic approach in diagnosis with SARS-CoV-2 infected COVID-19 patients” Journal of Infection 81 (2020) e28–e32
